- Маркировка лекарственных средств
- Маркировка лекарственных препаратов: в чем ее суть?
- Принципы функционирования системы мониторинга фармпрепаратов
- 1. Прием товара в аптеке и маркировка
- 2. Розничная продажа лекарств в аптеках
- Как производителю работать с маркировкой
- Как отсканировать код
- Текущие недоработки системы
- Штрафы за отсутствие маркировки
- Какие нормативно-правовые акты регулируют маркировку лекарств
- Как работает ФГИС МДЛП
- Каким требованиям должны отвечать участники оборота лекарственных препаратов
- Порядок регистрации в системе маркировки лекарств
- Перенос маркировки лекарств
- О системе мониторинга лекарств
- Лекарства маркируют производители и импортеры
- Как работать с маркировкой
- Какие лекарства нужно маркировать
- Штрафы до 300 000 ₽ за лекарства без маркировки
- В чём плюсы маркировки лекарств
Маркировка лекарственных средств
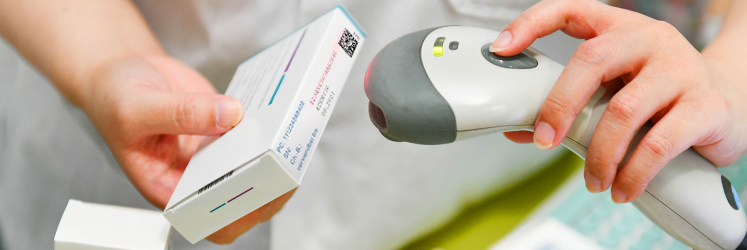
В июле 2020 года стартовал последний этап обязательной маркировки лекарственных препаратов и фармацевтических товаров. Однако в отдельных случаях можно получить отсрочку. Для этого необходимо обратиться в Росздравнадзор за специальным согласованием, которое дает право отгружать, принимать и продавать медикаменты без штрих-кода Data Matrix. Что еще нужно знать о маркировке лекарств? Вся необходимая информация — в нашей статье.
Маркировка лекарственных препаратов: в чем ее суть?
Маркировка — это нанесение на сам фармацевтический продукт, его упаковку (вторичную — в которой размещен он сам, или транспортную — в которое располагается несколько вторичных упаковок) марки — идентификатора, подтверждающего подлинность товара.
Марку «привязывает» к товару или к его упаковке производитель (импортер) лекарственных средств. Далее он передает товар оптовикам, а те — в розничные точки. Каждый из участников оборота товара — производитель (импортер), оптовик и розничный продавец, в установленном порядке фиксируют совершение тех или иных операций с товаром, на который нанесена марка.
Как правило, это две основные операции — приемка и последующий отпуск потребителю (розничному продавцу — от оптовика, физическому лицу — от розничного продавца). Все они складываются в логистическую цепочку: в целостном виде она точно удостоверяет, что промаркированный товар прошел полный путь от производителя до розничного прилавка. А значит — то, что товар подлинный.
Несколько шагов и Модулькасса ваша
Для малого и среднего бизнеса

Шаг 1 из 2
Выберите состав комплекта
Стандартная Модулькасса
11 900 ₽
Модулькасса с встроенным эквайрингом
24 900 ₽
Шаг 2 из 2
Оставьте, пожалуйста, свои контакты
«Вклиниться» в эту цепочку несанкционированному участнику сложно, поскольку регистрация всех операций участниками данной цепочки осуществляется с использованием квалифицированных электронных подписей (КЭП). То есть, чтобы «вклиниться», надо эту подпись подделать или получить в распоряжение. Оба действия легко обнаруживаются участниками оборота — и по факту такого обнаружения поставка блокируется, поскольку никто не заинтересован в том, чтобы в оборот попадал контрафакт.
Таким образом, маркировка сводит к минимуму появление на прилавках поддельных товаров.
Особенно это важно в фарминдустрии. Поэтому, внедрению системы маркировки лекарственных средств государство уделило повышенное внимание и учредило целую систему мониторинга движения лекарственных препаратов — МДЛП.
Участие в обороте маркированных фармацевтических товаров осуществляют, таким образом, его производители, оптовики и те хозяйствующие субъекты, которые обеспечивают реализацию или практическое использование лекарственных средств:
- розничные точки — аптеки;
- медицинские организации — использующие препараты по назначению.
Участие каждого из указанных категорий хозяйствующих субъектов в обороте маркируемой фармацевтической продукции осуществляется по-разному. Рассмотрим, какие установлены в отношении такого участия правила, которым обязаны следовать розничные фармпредприятия — представляющие собой, возможно, самую массовую категорию субъектов, которые осуществляют операции с медикаментами.
Принципы функционирования системы мониторинга фармпрепаратов
На первом звене всей цепочки проставляется QR-код, который впоследствии будет основным средством проверки подлинности. Это делается на заводе. При передаче дистрибьютору информация обновляется, также – при переходе на место продажи или в больницу. Отслеживается весь путь, вплоть до реализации покупателю или пациенту. Тогда код выходит из оборота.
С момента производства контролирующие органы могут видеть, где находится препарат и сколько осталось до конца срока годности.
1. Прием товара в аптеке и маркировка
Отгрузка лекарственных средств может проходить по прямому или обратному акцепту. Прямая передача подразумевает двойную проверку, защищает от пересортицы. Поставщик отправляет в систему сообщение о сборе заказа с полным перечнем. Получатель после сверки фактического наличия с данными электронного документа подтверждает прием в системе. В случае несовпадения отдельных позиций оформляет возврат.
В систему маркировки лекарств при обратном акцепте данные заносятся один раз. Поставщик отправляет груз по ТТН, не отправляя данные в систему. Получатель, в данном случае аптека, принимает товар и вносит данные в МДЛП. К отправителю приходит электронное уведомление о получении товара. Он должен согласится со списком, если данные совпадают, либо опровергнуть его при наличии расхождений.
Программа маркировки лекарств позволяет оперативно принять партию любого объема. Со специализированным ПО вы сможете выполнить прием, возврат, отказ от приема и выбытие ЛС, а также узнать статус маркировочного кода препарата.

2. Розничная продажа лекарств в аптеках
Выбытие лекарственных средств осуществляется несколькими способами: через онлайн-кассу, регистратор выбытия, программу учета, способную взаимодействовать с ИС МДЛП, и через личный кабинет Честного ЗНАКа. Аптекам, работающим только со льготными препаратами без использования онлайн-касс, оператор предоставляет регистратор выбытия.
Помимо реализации, существует еще несколько причин выбытия лекарств из оборота:
- уничтожение препарата;
- списание без передачи на уничтожение;
- утеря (недостача);
- производственный брак;
- частичное списание (разукомплектация) и иное.
Закажите кассу и начинайте продавать
С Модулькассой это будет быстрее и удобнее
Оставляя заявку, вы соглашаетесь на обработку персональной информации ООО «Аванпост»
Спасибо! Скоро наш оператор свяжется с вами для подтверждения заказа.

Эти операции проводятся через личный кабинет или программу учета, например, «Астрал.Маркировка», «1С:Розница.Аптека». Работа с ИС маркировки лекарств в больничной аптеке аналогичная деятельности городских аптечных пунктов. Однако они используют специализированные программы учета, например, «1С:Медицина. Больничная аптека». Это обусловлено более широким список выполняемых функций. Больничные аптеки могут работать с населением либо предоставлять препараты исключительно в медицинские учреждения. Они могут также заниматься производством отдельных препаратов, выступая в этом случае в качестве производителя.

Как производителю работать с маркировкой
Производитель обязан наносить на каждую потребительскую упаковку уникальный двумерный код Data Matrix. Этот код содержит информацию о препарате:
- серийный номер мед. препарата (GTIN) и номер партии;
- идентификатор ключа и код проверки криптозащиты (ГОСТ 34.10-2012).
Помимо этого, при необходимости он может содержать наименование препарата и производителя, срок годности лекарства, инструкцию по использованию и другую информацию.
Как отсканировать код
Если лекарство не настоящее, программа тут же сообщит об этом. Считыватель наводится на штрихкод. Считывается он автоматически, а затем – выводит новую информацию. Работать подобный механизм может как на смартфонах, так и в зале аптеки.
Текущие недоработки системы
Дублирование наименований лекарств
Работа в ИС «Маркировка» построена так, что одна из сторон соглашается с тем, какая информация ей передается. И возможности ее редактирования нет. При этом одинаковые лекарственные препараты в документах разных контрагентов могут называться по-разному. Это приводит к дублям в системе учета, от которых не избавиться. Когда появится единый реестр с названиями препаратов, неизвестно.
Передача информации о выводе лекарств из оборота раньше их использования
Маркировка только вторичной упаковки привела к тому, что при отгрузке ЛП для медицинского применения в систему мониторинга выгружается информация только о ней. То есть препараты выводятся из оборота раньше, чем могут быть израсходованы. Поэтому возникают ситуации, когда по законным причинам лекарства могут быть не израсходованы, но выведены из оборота. Механизм обратного ввода в оборот существует. Но в случае с медорганизациями пока не понятно, что является достаточным основанием для этого.
Брак при нанесении штрихкодов с криптозащитой
Есть нерешенные проблемы и на этапе упаковки препаратов. Фармпроизводители утверждают, что при нанесении штрихкодов с криптозащитой, процент брака доходит до 89%. Связано это с длиной электронной подписи. По действующим нормативным актам она должна состоять из 88 знаков. Производители просят ее сократить до 20. Вопрос пока не решен, однако переносить сроки внедрения обязательной маркировки не планируется.
Согласно постановлению Правительства РФ от 14.12.2018 г. № 1557, субъекты обращения лекарственных средств из перечня высокозатратных нозологий обязаны зарегистрироваться в ИС «Маркировка» в период с 1 июля по 8 июля 2019 г. После регистрации есть 21 календарный день на подготовку к информационному взаимодействию с системой и оформление заявки для участия в тестировании, которое продлится 2 месяца.
Штрафы за отсутствие маркировки
За нарушение правил реализации товаров, подлежащих обязательной маркировке, российским законодательством предусмотрена ответственность
- Административная (ст. 15.12 КоАП):
— для индивидуального предпринимателя — штраф от 5 000 до 10 000 рублей;
— для юридического лица — штраф от 50 000 до 300 000 рублей. - Уголовная (ч. 1 ст. 171.1 УК):
— Если стоимость изделий без маркировки более 1,5 миллионов рублей, виновному грозит лишение свободы до 3 лет и штраф 80 000 рублей.
Подключиться к Честному Знаку
Для маркировки лекарств используется система автоматизированного учёта и мониторинга движения лекарственных препаратов медицинского назначения (МДЛП). Она дополняет государственную регистрацию и экспертизу лекарств, позволяя отслеживать все этапы их оборота — от производителя до конечного потребителя. Основная цель внедрения системы — борьба с контрафактной продукцией.
МДЛП создавалась и развивалась в несколько этапов:
- 1 февраля 2017 года — начало эксперимента и создание системы под контролем Минздрава, Росздравнадзора, Минпромторга и ФНС.
- 1 ноября 2018 года — переход системы МДЛП к оператору Центр развития перспективных технологий (Оператор-ЦРПТ) и её включение в единую национальную систему маркировки и прослеживаемости товаров Честный ЗНАК.
- 1 июля 2019 года — начало регистрации аптек и медицинских учреждений в системе МДЛП для работы с препаратами из перечня высокозатратных нозологий.
- 1 октября 2019 года — начало обязательной маркировки первой категории лекарств — препаратов из перечня федеральной программы «Семь высокозатратных нозологий» (7ВЗН).
- 1 января 2020 года — плановый срок начала обязательной маркировки всех лекарственных препаратов (перенесён из-за неготовности участников оборота).
- 1 июля 2020 года — начало обязательной маркировки лекарств с массовым запуском системы мониторинга.
Какие нормативно-правовые акты регулируют маркировку лекарств
Поскольку проект по маркировке лекарственных препаратов реализуется на протяжении уже нескольких лет, нормативная база создавалась постепенно. На сегодняшний день она представлена:
- Федеральным законом «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ в последней редакции.
- Постановлением Правительства РФ от 24 января 2017 г. № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» с изменениями и дополнениями от 30.12.2017, 28.08.2018 и 07.08.2019.
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» с изменениями и дополнениями от 30.08.2019.
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1557 «Об особенностях внедрения системы мониторинга движения лекарственных препаратов для медицинского применения».
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1558 «Об утверждении Правил размещения общедоступной информации, содержащейся в системе мониторинга движения лекарственных препаратов для медицинского применения, в информационно-телекоммуникационной сети „Интернет“ (в том числе в форме открытых данных)».
- Постановлением Правительства РФ от 8 мая 2019 г. № 577 «Об утверждении размера платы за оказание услуг по предоставлению кодов маркировки, необходимых для формирования средств идентификации и обеспечения мониторинга движения товаров, подлежащих обязательной маркировке средствами идентификации, а также о порядке её взимания».
Как работает ФГИС МДЛП
В системе регистрируются участники оборота лекарственных препаратов медицинского назначения:
- производители;
- дистрибьюторы и логистические компании;
- аптеки;
- медицинские организации.
До 1 июля 2020 года любой из участников рынка мог добровольно зарегистрироваться в системе и принять участие в эксперименте по маркировке. При этом все основные расходы покрывались оператором системы, участники могли постепенно тестировать новые бизнес-процессы и внедрять их в свою деятельность.
С 1 июля 2020 года обязанность по маркировке лекарственных препаратов распространится на все лекарства и всех участников оборота.
Оборот немаркированных лекарств с 1 июля 2020 года будет запрещён, за исключением:
- препаратов, произведённых до 1 июля 2020 года;
- препаратов, произведённых до 31 декабря 2019 года и предназначенных для обеспечения больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, а также для обеспечения лиц после трансплантации органов и (или) тканей.
Указанные выше лекарства можно реализовывать, хранить и применять до истечения срока годности.
Для каждого участника в системе МДЛП создаётся свой личный кабинет и предусмотрен свой набор действий по регистрации, направлению сведений в систему и информационному взаимодействию.
Общая схема работы в системе МДЛП:
- Зарегистрированные в системе производители наносят на каждую упаковку лекарственного препарата уникальный идентификационный код — DataMatrix. Код запрашивается у оператора системы через регистратор эмиссии и выдаётся системой. Он наносится на потребительскую (вторичную) упаковку, а если её нет — на первичную упаковку. Сведения о маркировке производители направляют в систему МДЛП.
- Дистрибьюторы, логистические компании и аптеки считывают код с каждого товара и передают в систему сведения о полученных и реализованных лекарственных препаратах.
- Аптеки, осуществляющие бесплатную выдачу лекарств по рецептам, и медицинские организации передают через регистратор выбытия в систему сведения о расходе лекарственных препаратов.
Каким требованиям должны отвечать участники оборота лекарственных препаратов
Маркировка не отменяет обязанностей участников оборота, связанных с экспертизой и государственной регистрацией лекарственных препаратов, как и в целом требований, предъявляемых к участникам рынка в соответствии с №61-ФЗ «Об обращении лекарственных средств». Однако в связи с внедрением обязательной маркировки появился ряд новых требований — они обеспечивают возможность работы в системе МДЛП и предусматривают:
- Наличие специального оборудования и программного обеспечения.
- Регистрацию в системе, для чего нужна квалифицированная электронная подпись.
- Соблюдение установленного порядка передачи сведений в систему для регистрации, маркировки и учёта движения лекарственных препаратов.
Производители (фармацевтические компании) должны быть оснащены регистратором эмиссии — промышленным программно-аппаратным комплексом для генерации ключа и проверочного кода, а также хранения кодов маркировки. Для его получения нужно подать заявку Оператору-ЦРПТ. С производителем заключаются договоры по предоставлению регистратора эмиссии и оказанию услуг по предоставлению кодов маркировки.
Медицинские организации и аптеки, осуществляющие бесплатную реализацию маркированных лекарственных препаратов, должны быть оснащены регистраторами выбытия по количеству мест ведения деятельности. Регистратор — это аналог онлайн-кассы, только для фиксации бесплатного отпуска лекарств. Устройства поставляются Оператором-ЦРПТ, который также обеспечивает их обслуживание.
Не требуется оснащать регистратором выбытия:
- медучреждения Минобороны;
- медицинские (врачебные) кабинеты, действующие в школах, детсадах или в других организациях, при условии, что такие кабинеты входят в структуру медицинской организации;
- структурные подразделения, которые получают препараты из своей головной медицинской организации;
- аптеки (пункты, киоски), которые не реализуют препараты на бесплатной основе по рецепту.
Аптеки, которые занимаются розничной продажей лекарственных препаратов, могут ограничиться имеющимся оборудованием — онлайн-кассой и присоединённым сканером для считывания кода (2D сканер штрихкода). Если розничной продаже сопутствует выдача лекарств по льготным рецептам, нужно дополнительно оснастить аптеку регистратором выбытия.
Зарегистрированные дистрибьюторы используют имеющиеся программно-технические средства, но их обязательно необходимо интегрировать с системой МДЛП (в составе системы Честный ЗНАК).
Порядок регистрации в системе маркировки лекарств
С 1 июля 2020 года регистрацию должны пройти участники оборота лекарств, которые:
- не принимали участия в эксперименте;
- не попали под требования обязательной маркировки лекарств из перечня высокозатратных нозологий;
- только начинают свою деятельность на рынке производства и реализации лекарственных препаратов.
Для каждого из участников оборота (производитель, дистрибьютор, аптека, медучреждение) предусмотрен специфический набор действий по регистрации в системе и внедрению процессов в свою деятельность.
Все участники предварительно должны:
- Оформить усиленную квалифицированную электронную подпись (УКЭП) в одном из удостоверяющих центров, аккредитованных Минкомсвязью России. При наличии УКЭП необходимо проверить её соответствие требованиям. Она должна быть получена на имя руководителя юридического лица или на ИП, быть действующей, а указанные при оформлении сведения — точно совпадать с данными ЕГРЮЛ или ЕГРИП.
- Установить программное обеспечение и настроить его для работы с УКЭП.
Производители должны:
- Зарегистрироваться в системе Честный ЗНАК. Первично регистрируется онлайн-заявка, после чего на электронную почту поступает информационное письмо с логином и паролем для входа в систему. Для завершения регистрации в системе нужно в течение десяти дней после подачи заявки направить в Росздравнадзор оригиналы документов.
- Заполнить профиль в личном кабинете.
- Зарегистрировать в системе места деятельности (производства), используемые на предприятии учётные системы и выпускаемые лекарственные препараты. Для регистрации лекарств обязательно указываются: GTIN товара (ЮНИСКАН ГС1 РУС), номер регистрационного удостоверения препарата и дата его регистрации.
- Установить, внедрить оборудование для взаимодействия с системой и наладить его работу. Это комплексная процедура, часть технологических и бизнес-процессов фармпроизводителя. В результате должны быть обеспечены нанесение кодов Data Matrix, их верификация, интеграция процессов с системой управления заказами (СУЗ) и системой Честный ЗНАК. Основные компоненты промышленного программно-аппаратного комплекса — регистратор эмиссии, СУЗ, интеграционное программное обеспечение.
- Протестировать работу программно-аппаратного комплекса и, если необходимо, обучить персонал.
Дистрибьюторы должны:
- Зарегистрироваться в системе Честный ЗНАК, направив онлайн-заявку. По результатам рассмотрения заявки на электронную почту придёт письмо с логином и паролем для входа в систему.
- Интегрировать используемые программно-аппаратные комплексы (устройства и средства) с системой Честный ЗНАК.
- Протестировать процессы, порядок действий при приёмке лекарственных препаратов, формировании заказов и их отправке в аптечные и медицинские организации. В рамках тестирования необходимо заказать в техподдержке системы МДЛП тестовые коды и выполнить операции в тестовом контуре.
Аптеки должны:
- Зарегистрироваться в системе Честный ЗНАК, направив онлайн-заявку. По результатам её рассмотрения получить логин и пароль для входа в систему.
- Обновить программное обеспечение онлайн-кассы для передачи ОФД сведений о продаже маркированных лекарств. Проверить способность имеющегося 2D сканера штрихкода считывать DataMatrix, при необходимости приобрести такой сканер.
- Получить у Оператора-ЦРПТ и установить регистраторы выбытия в количестве, соответствующем числу мест ведения деятельности согласно данным лицензии (только для аптек, осуществляющих бесплатный отпуск лекарств).
- Протестировать процессы и действия в рамках работы с системой МДЛП. Для этого в техподдержке заказываются коды и выполняются операции в тестовом контуре.
- Устранить выявленные в ходе тестирования проблемы.
Медицинские организации должны:
- Зарегистрироваться в системе Честный ЗНАК, направив онлайн-заявку. Получить логин и пароль для входа в систему.
- Получить у Оператора-ЦРПТ и установить регистраторы выбытия в количестве, соответствующем числу мест ведения деятельности согласно данным лицензии.
- Оборудовать рабочие места, установить необходимое для работы в системе программное обеспечение и оборудование, протестировать его. Программно-аппаратный комплекс включает регистратор выбытия, 2D сканер штрихкода, способный считывать DataMatrix, и медицинскую информационную систему (МИС), которая соответствует требованиям системы МДЛП. Работоспособность комплекса проверяется в тестовом контуре с помощью тестовых кодов, полученных в техподдержке системы МДЛП.
- Устранить выявленные в ходе тестирования проблемы и обучить персонал работе в системе.
Эта статья была полезной?
Подключитесь к ЭДО для маркировки
Заполните заявку вручную или загрузите сертификат ЭП
Перенос маркировки лекарств
Маркировку лекарств планировали начать с 1 января 2020 года, но сроки решили сдвинуть на полгода: маркировка станет обязательной с 1 июля 2020 года.
С учетом переноса сроки маркировки лекарств такие:
- 1 июля 2019 года — регистрация участников рынка лекарств из перечня высокозатратных нозологий в системе «Честный знак;
- 1 октября 2019 года — нанесение кода на упаковку лекарств из перечня высокозатратных нозологий, передача информации о движении и продаже таких лекарств в системе мониторинга;
- 1 июля 2020 года — регистрация всех участников рынка лекарств в системе мониторинга, нанесение кода на упаковки всех лекарств и передача информации об их движении, продаже или использовании.
До 1 июля 2020 года маркировка обязательна для лекарств из перечня высокозатратных нозологий, например это октоког альфа, соматропин, флударабин, а с 1 июля 2020 года — для всех остальных.
О системе мониторинга лекарств
Лекарства с маркировкой нужно будет регистрировать в системе мониторинга, она называется ИС МДЛП или МДЛП — информационная система мониторинга движения лекарственных препаратов. Мы ее будем называть системой мониторинга лекарств.
Система мониторинга лекарств управляется центром развития перспективных технологий «Честный знак», как и системы мониторинга табака, шуб и обуви.
С системой мониторинга работают все участники рынка лекарств: производители, импортеры, дистрибьюторы, аптеки, государственные больницы, коммерческие клиники и компании, которые оказывают медицинские услуги с использованием лекарств, например стоматологии, ветеринарные клиники и косметологические кабинеты.
Читать в Деле
Как устроен рынок фармацевтики в России
Лекарства маркируют производители и импортеры
Лекарства маркируют производители и импортеры: наносят код на каждую упаковку, а затем передают сведения об операциях с лекарствами в систему мониторинга. Операциями считаются передача логистической компании, оптовая или розничная продажа, уничтожение.
Чтобы маркировать лекарства, нужно:
- оформить усиленную квалифицированную электронную подпись, она же УКЭП. Подпись должна быть выпущена на директора компании, она понадобится для регистрации в системе;
- зарегистрироваться в системе мониторинга лекарств. При регистрации попросят указать сведения о лицензии, ИНН, место регистрации компании и контакты ответственного за маркировку сотрудника;
- заполнить описания лекарства в системе мониторинга. Информацию для описаний нужно брать из Юнискана ГС-1 Рус;
- получить регистратор эмиссии. Это криптографическое программно-аппаратное средство, с помощью которого производитель получает коды маркировки по зашифрованным каналам. Регистратор эмиссии выдается бесплатно;
- получить коды через регистратор эмиссии и оплатить их. Один код стоит 50 копеек плюс НДС — 10 копеек;
- нанести коды на каждую упаковку лекарств. Код маркировки нужно наносить на вторичную упаковку, а если ее нет — на первичную. Например, для ампул вторичной упаковкой будет картонная коробочка, в которой они продаются, а первичной — сама ампула;
- проверить считываемость кодов с помощью сканера;
- интегрировать систему управления заказов — это система, через которую производитель получает коды, с системой мониторинга лекарств;
- передавать сведения об операциях с лекарствами в систему мониторинга.
Заявка на регистратор эмиссии заполняется в личном кабинете системы «Честный знак» в разделе Профиль — Анкеты и договоры
Остальные участники рынка не наносят маркировку, а только передают сведения об операциях с лекарствами — продаже, выдаче или использовании.
Сейчас аптеки продают некоторые лекарства поштучно, например пакетик Смекты или пять ампул антибиотика из коробки с десятью ампулами. Это помогает покупателям экономить: упаковка с десятью ампулами может стоит 8000 рублей, и, если врач прописал пять уколов, выгоднее купить половинку.
Но из-за того, что код маркировки лекарств должен наноситься на вторичную упаковку — коробку, а на ампулах, пакетиках со смесями и блистерах маркировки нет, скорее всего, поштучная продажа будет запрещена.
Как работать с маркировкой
Все участники рынка лекарств регистрируются в системе мониторинга — это первый шаг, и он одинаковый. А вот дальнейшие шаги отличаются.
Дистрибьюторы и логистические компании передают сведения о полученных от производителя и проданных лекарствах в систему мониторинга. Для этого понадобится:
- интегрировать складское программное обеспечение с системой мониторинга лекарств;
- отправлять сведения о покупке или продаже лекарств в систему.
Аптеки передают сведения о полученных от поставщиков лекарствах в систему мониторинга и о проданных упаковках через кассы. Им нужно:
- обновить прошивку онлайн-кассы;
- подключить к кассе 2D-сканер штрих-кодов, если раньше его не использовали;
- обновить кассовую программу;
- получить регистратор выбытия, если аптека выдает лекарства бесплатно, например по льготным рецептам. Такие лекарства проводят через регистратор выбытия, а не кассу. Устройство получают бесплатно в личном кабинете системы «Честный знак»;
- отправлять сведения о получении, продаже или выдачи лекарств в систему через кассу, регистратор выбытия или вручную.
Какой чек пробивать и когда пользоваться регистратором выбытия, зависит от ситуации.
Ситуация
Что делать
Аптека продает лекарства обычному покупателю
Выбить чек через кассу, в одном чеке может быть всё, что купили: лекарства, салфетки, жвачка и клизма
Аптека продает лекарство со скидкой по льготному рецепту
Выбить чек через кассу, на лекарство со скидкой один чек, на все остальные покупки — другой
Аптека выдает лекарство бесплатно по льготному рецепту
Провести лекарство через регистратор выбытия
Аптека находится в удаленной местности, где касса работает в автономном режиме и ничего не передает оператору фискальных данных
Списать лекарство вручную в системе мониторинга
Аптека работает при фельдшерско-акушерском пункте без кассы
Списать лекарство вручную в системе мониторинга
Государственные больницы передают сведения о полученных от поставщиков лекарствах в систему мониторинга, а потом — информацию об использованных лекарствах через регистратор выбытия. Им понадобится:
- интегрировать больничное ПО с системой мониторинга лекарств;
- получить бесплатный регистратор выбытия. Для этого нужно заполнить заявку в личном кабинете системы «Честный знак»;
- отправлять сведения о выдаче или использовании лекарств в систему.
Если в больнице несколько корпусов и складов, на которых работают разные сотрудники, нужно получить регистраторы выбытия и оформить усиленные электронные подписи на каждого, кто будет работать с системой мониторинга. Потому что с одной подписью в один момент может работать только один сотрудник.
Частные клиники, которые используют в работе лекарства. Это клиники общего профиля, стоматологии, косметологические кабинеты, реабилитационные центры и все остальные. Они передают в систему мониторинга сведения об использовании или продаже лекарств.
У частных клиник есть два сценария: пробивать лекарства через кассу или списывать через систему. Какой использовать, зависит от наличия лицензии на фармацевтическую деятельность, она же продажа лекарств:
- есть лицензия на продажу лекарств. Клиника может использовать оба сценария: пробивать лекарства через кассу или списывать в системе мониторинга — на выбор;
- нет лицензии. Клиника пробивает через кассу только услуги, а лекарства списывает в системе мониторинга.
К примеру, косметологическая клиника делает уколы ботокса, но у нее нет лицензии на продажу самого ботокса, только на оказание услуг. Клиника пробивает клиенту чек на услугу «Уколы ботокса», а ампулу с ботоксом списывает в системе мониторинга.
Еще аптеки, частные клиники и больницы взаимодействуют с производителями и поставщиками — обе стороны подтверждают отправку и получение лекарств. Есть два варианта подтверждения:
- прямой. Поставщик первым отправляет в систему данные о том, что он поставил в аптеку столько-то упаковок таких-то лекарств, а аптека у себя в системе подтверждает, что получила именно эти лекарства;
- обратный. Аптека или клиника отправляет в систему данные о том, что получила столько-то упаковок таких-то лекарств, а поставщик у себя в системе подтверждает, что именно эти лекарства отправил.
Поставщик и получатель должны договориться, кто первым отправляет подтверждение о передаче лекарств, но при любом варианте сделать это должны оба. Только после двойного подтверждения лекарства можно продавать или выдавать бесплатно.
Какие лекарства нужно маркировать
С 1 июля 2020 года производители обязаны маркировать все лекарства, кроме бадов. По закону лекарствами считаются:
«вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, прерывания или сохранения беременности».
Получается, ветеринарные лекарства тоже нужно маркировать.
Штрафы до 300 000 ₽ за лекарства без маркировки
С 1 июля 2020 года маркировка лекарств станет обязательной, а значит, будут штрафы.
Штрафы за производство лекарств без маркировки:
- для ИП — от 5000 до 10 000 рублей;
- для компаний — от 50 000 до 100 000 рублей.
За продажу и выдачу лекарств без маркировки:
- для ИП — от 2000 до 4000 рублей;
- для компаний — от 50 000 до 300 000 рублей.
Если выявят нарушение, оштрафуют и конфискуют немаркированные лекарства. Исключение — лекарства, которые были выпущены без маркировки до 1 июля 2020 года, — их можно продавать до конца срока годности.
В чём плюсы маркировки лекарств
У маркировки лекарств есть плюсы для потребителей и продавцов: подлинность лекарств, контроль сроков годности и упрощенный учет партий.
Подлинность. После введения обязательной маркировки потребители смогут проверять подлинность лекарств в приложении «Честный знак» и сообщать о нарушениях. Это поможет честным продавцам бороться с подделками, а потребителям — получать качественные лекарства.
Контроль сроков годности. В код маркировки зашивается срок годности, и, если у лекарства он истек, система мониторинга автоматически его спишет, а касса не даст провести. Это значит, что аптеки не смогут продавать просроченные лекарства, а система мониторинга поможет следить за тем, у каких лекарств на складе скоро истечет срок годности.
Упрощенный учет. Есть лекарства, цена которых зависит от партии поставки. Например, к ним относятся все жизненно необходимые лекарства: наценку на них регулирует государство, она может меняться. Поэтому лекарства из одной партии стоят 100 рублей, а из следующей — 105 рублей, и аптека не вправе продавать упаковки из разных партий по одной цене.
Чтобы контролировать цены лекарств из разных партий, аптеки ведут серийный учет, например клеят вручную внутренние штрихкоды с серийными номерами на каждую упаковку. После введения маркировки станет возможным появление системы, которая будет автоматически учитывать партию поставки. Это значит, что учет лекарств станет проще.
