Маркировка — это нанесение производителем или импортером на продукт, вторичную или транспортную упаковку специальной марки, которая является идентификатором, подтверждающим подлинность товара.

Маркировка лекарственных средств имеет свои чёткие правила. Основные прописаны в Федеральном законе от 12.04.2010 «Об обращении лекарственных средств» (далее Федеральный закон № 61-ФЗ). Любое нарушение недопустимо, а нарушитель будет привлечён к административной ответственности.
Маркировка лекарственных средств — нормативная база
Первичная и вторичная упаковки и их маркировка
Подробнее о правилах упаковки и маркировки лекарственных средств
«Честный знак» — маркировка лекарств
На сегодняшний день маркировка лекарственных средств и фармацевтических товаров является обязательной мерой. Поэтому компании и индивидуальные предприниматели, которые занимаются продажей медикаментов, где нет чипов, подвергаются штрафным санкциям. Также штрафы начисляются, если выявляются нарушения, когда данные передаются в систему мониторинга. Какие основные требования к маркировке лекарственных препаратов в РФ, чтобы избежать штрафных санкций?
- Что такое код маркировки лекарственных препаратов? Для чего предназначается?
- Основные задачи маркировки и мониторинга перемещения медикаментов
- Какие организации являются пользователями системы маркировки лекарств?
- О системе мониторинга лекарств
- Штрафные санкции
- Порядок регистрации в системе маркировки лекарств
- Какие лекарства подлежат маркировке?
- Штрафы до 300 000 ₽ за лекарства без маркировки
- Как работает ФГИС МДЛП
- Маркировка лекарственных средств — нормативная база
- Кто участвует в системе маркировки
- Подробнее о правилах упаковки и маркировки лекарственных средств
- Как работать с маркировкой
- Транспортная тара и требования к её маркировке
- Как работает система маркировки
- Каким требованиям должны отвечать участники оборота лекарственных препаратов
- Вопросы и ответы
- Что делать, если покупатель отказался от покупки?
- Первичная и вторичная упаковки и их маркировка
- Подытожим
- Какие лекарства нужно маркировать
- Функции маркировки на фармацевтическом рынке
- Особенности работы с системой маркировки
- Розничная продажа лекарств в аптеках
- Задачи системы мониторинга перемещения лекарственных препаратов
- Лекарства маркируют производители и импортеры
- Маркировка лекарственных средств и сроки ее проведения
- «Честный знак» — маркировка лекарств
- Особенности регистрации
- Какие нормативно-правовые акты регулируют маркировку лекарств
- В чём плюсы маркировки лекарств
- Заключение
Что такое код маркировки лекарственных препаратов? Для чего предназначается?
Data Matrix является уникальным двумерным штрих-кодом, который состоит из цифр и букв. В его составе код идентификации и код проверки.
Код идентификации состоит из двух частей. Первой является международный код товара GTIN. В нем 14 знаков. Второй частью является индивидуальный серийный номер из 13 символов. При этом на медикаментозные препараты наносится не только штрих-код, но и фрагмент текста. Данное требование распространяется только на медикаменты, для других видов продукции оно не действует.
Кодом идентификации называется электронная подпись, состоящая из четырех символов ключа и 44 символов значения кода. Данная подпись позволяет осуществить проверку лекарственного средства на предмет его законности.
Обязательная маркировка лекарств находится на их упаковке. Как правило, это может быть коробка из картона, а при ее отсутствии, блистер, ампула и др. Также код может печататься на этикетке, если она не отделяется от упаковки без повреждений.
Маркироваться должна и транспортная упаковка с продукцией фармакологической отрасли. Здесь ставится групповой штрих-код, а не Data Matrix. Допускается, чтобы он был линейный, а не двумерный.
Основные задачи маркировки и мониторинга перемещения медикаментов
Используя маркировку и отслеживая движение лекарственных препаратов, государство:
- исключает поступление в оборот и автоматическое изъятие из него медикаментов низкого качества, фальсифицированных, контрафактных на любом из этапов их оборота на всей территории страны;
- предотвращает неэффективные расходы и экономит средства бюджета, потому что исключен «повторный вброс» медикаментов; предотвращает легальную продажу средств, которые подлежат предметно-количественному учету и не предназначаются для реализации в розницу;
- контролирует адресность перемещения медикаментов, для закупки которых выделяются средства из бюджета, расходы на их приобретение, ценообразование и предельные розничные цены на препараты, которые относятся к жизненно необходимым;
- оперативно планирует и управляет запасами и резервами медикаментов всех уровней.
Преимущества для граждан страны заключаются в том, что в любой момент можно проверить, является ли легальным конкретный препарат. Для этого потребуется только смартфон и доступ в интернет.
Компании и индивидуальные предприниматели получают возможность управлять логистикой более эффективно, снизить упущенную выгоду из-за контрафактной продукции и фальсификата, соответствовать требованиям в отношении поставок фармакологической продукции на международные рынки сбыта.
Для маркировки лекарств используется система автоматизированного учёта и мониторинга движения лекарственных препаратов медицинского назначения (МДЛП). Она дополняет государственную регистрацию и экспертизу лекарств, позволяя отслеживать все этапы их оборота — от производителя до конечного потребителя. Основная цель внедрения системы — борьба с контрафактной продукцией.
МДЛП создавалась и развивалась в несколько этапов:
- 1 февраля 2017 года — начало эксперимента и создание системы под контролем Минздрава, Росздравнадзора, Минпромторга и ФНС.
- 1 ноября 2018 года — переход системы МДЛП к оператору Центр развития перспективных технологий (Оператор-ЦРПТ) и её включение в единую национальную систему маркировки и прослеживаемости товаров Честный ЗНАК.
- 1 июля 2019 года — начало регистрации аптек и медицинских учреждений в системе МДЛП для работы с препаратами из перечня высокозатратных нозологий.
- 1 октября 2019 года — начало обязательной маркировки первой категории лекарств — препаратов из перечня федеральной программы «Семь высокозатратных нозологий» (7ВЗН).
- 1 января 2020 года — плановый срок начала обязательной маркировки всех лекарственных препаратов (перенесён из-за неготовности участников оборота).
- 1 июля 2020 года — начало обязательной маркировки лекарств с массовым запуском системы мониторинга.
Какие организации являются пользователями системы маркировки лекарств?
Все юридические лица и индивидуальные предприниматели, которые задействованы в обороте медикаментов и других товаров фармацевтической промышленности, обязаны выполнять ряд действий для учета продукции в системе мониторинга лекарственных препаратов и их беспрепятственного перехода к другому следующему участнику.
Каждая организация в процессе обращения препаратов имеет свои обязанности:
- Производственные предприятия, организации-импортеры. При изготовлении или ввозе фармацевтической продукции на территорию РФ проставлять коды; отчитываться, когда новые коды вводятся в оборот; регистрировать в базе «Честный знак» партию продукции. Запросить штрих код маркировки лекарственных средств можно у оператора ЦРПТ. Когда продукция фармацевтической отрасли отгружается организациям, которые будут ее продавать, им отправляется список кодов, которые использовались. Это возможно благодаря системе электронного документооборота.
- Центры логистики, организации, занимающиеся дистрибуцией. Осуществляют прием товара, сканируя коды. Продукция извлекается из оптовых упаковок, распределяется на более мелкие и организовывается доставка в аптеки. Данные про все действия с продукцией фармацевтической отрасли передаются в систему мониторинга.
- Аптеки. Принимают фармацевтический товар, считывая двойные коды, вносят данные в систему оборота документов в электронной форме. Когда товары продаются через онлайн-кассу, делается скан кода маркировки лекарственных препаратов. Одновременно он попадает в чек и его получает оператор фискальных данных, а потом и система мониторинга. Далее происходит его удаление из обращения. Чтобы выполнить отпуск медикаментов бесплатно, используется регистратор выбытия. Данный аппарат выполняет списание препаратов, выдаваемых на основании рецепта или для оказания медицинской помощи.
- Больницы и медицинские центры. Принимая медикаменты, делают сканы кодов, данные отражаются в системе оборота документов в электронной форме. Должный отпуск лекарственных средств осуществляется с использованием регистра выбытия. Отчет про все операции (приемка, вывод из оборота и др.) направляется в систему мониторинга перемещения медикаментов.
О системе мониторинга лекарств
Лекарства с маркировкой нужно будет регистрировать в системе мониторинга, она называется ИС МДЛП или МДЛП — информационная система мониторинга движения лекарственных препаратов. Мы ее будем называть системой мониторинга лекарств.
Система мониторинга лекарств управляется центром развития перспективных технологий «Честный знак», как и системы мониторинга табака, шуб и обуви.
С системой мониторинга работают все участники рынка лекарств: производители, импортеры, дистрибьюторы, аптеки, государственные больницы, коммерческие клиники и компании, которые оказывают медицинские услуги с использованием лекарств, например стоматологии, ветеринарные клиники и косметологические кабинеты.
Как устроен рынок фармацевтики в России
Маркировку лекарств планировали начать с 1 января 2020 года, но сроки решили сдвинуть на полгода: маркировка станет обязательной с 1 июля 2020 года.
С учетом переноса сроки маркировки лекарств такие:
- 1 июля 2019 года — регистрация участников рынка лекарств из перечня высокозатратных нозологий в системе «Честный знак;
- 1 октября 2019 года — нанесение кода на упаковку лекарств из перечня высокозатратных нозологий, передача информации о движении и продаже таких лекарств в системе мониторинга;
- 1 июля 2020 года — регистрация всех участников рынка лекарств в системе мониторинга, нанесение кода на упаковки всех лекарств и передача информации об их движении, продаже или использовании.
До 1 июля 2020 года маркировка обязательна для лекарств из перечня высокозатратных нозологий, например это октоког альфа, соматропин, флударабин, а с 1 июля 2020 года — для всех остальных.
Штрафные санкции
Если лекарственные препараты, подлежащие обязательной маркировке, выпускаются и продаются без соответствующего кода, с 01.07.2020 года накладываются штрафы, размеры которых следующие:
- 5-10 тыс. руб. – для физических лиц;
- 50-100 тыс. руб. – для юридических лиц.
Возможно участие в обороте препаратов без маркировочного кода, если они были выпущены до 01.07.2019 года, до момента окончания срока годности.
Центр развития перспективных технологий (ЦРПТ) является оператором системы мониторинга. За то, что он предоставляет коды маркировки, взимается плата, составляющая 50 коп (без НДС) за одну марку. Бесплатно получить код можно на медикаменты, которые относятся к категории жизненно необходимых, и отпускаются производителем по цене максимум 20 руб.
Зная лекарства, подлежащие обязательной маркировке, организации, которые занимаются сбытом, смогут избежать штрафов. Для потребителей это возможность защититься от фальсификата и некачественной продукции, сохранить свое здоровье.
Порядок регистрации в системе маркировки лекарств
С 1 июля 2020 года регистрацию должны пройти участники оборота лекарств, которые:
- не принимали участия в эксперименте;
- не попали под требования обязательной маркировки лекарств из перечня высокозатратных нозологий;
- только начинают свою деятельность на рынке производства и реализации лекарственных препаратов.
Для каждого из участников оборота (производитель, дистрибьютор, аптека, медучреждение) предусмотрен специфический набор действий по регистрации в системе и внедрению процессов в свою деятельность.
Все участники предварительно должны:
- Оформить усиленную квалифицированную электронную подпись (УКЭП) в одном из удостоверяющих центров, аккредитованных Минкомсвязью России. При наличии УКЭП необходимо проверить её соответствие требованиям. Она должна быть получена на имя руководителя юридического лица или на ИП, быть действующей, а указанные при оформлении сведения — точно совпадать с данными ЕГРЮЛ или ЕГРИП.
- Установить программное обеспечение и настроить его для работы с УКЭП.
- Заполнить профиль в личном кабинете.
- Зарегистрировать в системе места деятельности (производства), используемые на предприятии учётные системы и выпускаемые лекарственные препараты. Для регистрации лекарств обязательно указываются: GTIN товара (ЮНИСКАН ГС1 РУС), номер регистрационного удостоверения препарата и дата его регистрации.
- Установить, внедрить оборудование для взаимодействия с системой и наладить его работу. Это комплексная процедура, часть технологических и бизнес-процессов фармпроизводителя. В результате должны быть обеспечены нанесение кодов Data Matrix, их верификация, интеграция процессов с системой управления заказами (СУЗ) и системой Честный ЗНАК. Основные компоненты промышленного программно-аппаратного комплекса — регистратор эмиссии, СУЗ, интеграционное программное обеспечение.
- Протестировать работу программно-аппаратного комплекса и, если необходимо, обучить персонал.
- Интегрировать используемые программно-аппаратные комплексы (устройства и средства) с системой Честный ЗНАК.
- Протестировать процессы, порядок действий при приёмке лекарственных препаратов, формировании заказов и их отправке в аптечные и медицинские организации. В рамках тестирования необходимо заказать в техподдержке системы МДЛП тестовые коды и выполнить операции в тестовом контуре.
- Обновить программное обеспечение онлайн-кассы для передачи ОФД сведений о продаже маркированных лекарств. Проверить способность имеющегося 2D сканера штрихкода считывать DataMatrix, при необходимости приобрести такой сканер.
- Получить у Оператора-ЦРПТ и установить регистраторы выбытия в количестве, соответствующем числу мест ведения деятельности согласно данным лицензии (только для аптек, осуществляющих бесплатный отпуск лекарств).
- Протестировать процессы и действия в рамках работы с системой МДЛП. Для этого в техподдержке заказываются коды и выполняются операции в тестовом контуре.
- Устранить выявленные в ходе тестирования проблемы.
Медицинские организации должны:
- Получить у Оператора-ЦРПТ и установить регистраторы выбытия в количестве, соответствующем числу мест ведения деятельности согласно данным лицензии.
- Оборудовать рабочие места, установить необходимое для работы в системе программное обеспечение и оборудование, протестировать его. Программно-аппаратный комплекс включает регистратор выбытия, 2D сканер штрихкода, способный считывать DataMatrix, и медицинскую информационную систему (МИС), которая соответствует требованиям системы МДЛП. Работоспособность комплекса проверяется в тестовом контуре с помощью тестовых кодов, полученных в техподдержке системы МДЛП.
- Устранить выявленные в ходе тестирования проблемы и обучить персонал работе в системе.
Эта статья была полезной?
Подключитесь к ЭДО для маркировки
Заполните заявку вручную или загрузите сертификат ЭП
Какие лекарства подлежат маркировке?
Их перечень можно узнать на сайте государственного реестра медикаментов. Здесь нужно ввести конкретное название препарата. Если в реестре он отсутствует, маркировка не требуется.
Все виды медикаментозных препаратов должны маркироваться, начиная с 01.07.2020 года, что предусмотрено ст. 67 Федерального закона от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств».
Некоторые лекарственные средства подлежащие маркировке должны обязательно проходить данную процедуру еще с 2019 года. В их числе препараты, которые относятся к категории высокозатратных нозологий и используются в лечении следующих состояний:
- раковые процессы кроветворной, лимфоидной и приближенных к ним тканей;
- после перенесенных операций, в ходе которых была проведена трансплантация органов или тканей.
Обязательная маркировка лекарственных средств и ее особенности для лечения перечисленных состояний утверждается постановлением № 1557 от 14 декабря 2018 года, утвержденным Правительством РФ.
Основные моменты содержит Положение о системе мониторинга движения лекарств, которые применяются в медицине (постановление от 14 декабря 2018 года №1557, которое утвердило Правительство России).
Штрафы до 300 000 ₽ за лекарства без маркировки
С 1 июля 2020 года маркировка лекарств станет обязательной, а значит, будут штрафы.
Штрафы за производство лекарств без маркировки:
- для ИП — от 5000 до 10 000 рублей;
- для компаний — от 50 000 до 100 000 рублей.
За продажу и выдачу лекарств без маркировки:
- для ИП — от 2000 до 4000 рублей;
- для компаний — от 50 000 до 300 000 рублей.
Если выявят нарушение, оштрафуют и конфискуют немаркированные лекарства. Исключение — лекарства, которые были выпущены без маркировки до 1 июля 2020 года, — их можно продавать до конца срока годности.
Как работает ФГИС МДЛП
В системе регистрируются участники оборота лекарственных препаратов медицинского назначения:
- производители;
- дистрибьюторы и логистические компании;
- аптеки;
- медицинские организации.
С 1 июля 2020 года обязанность по маркировке лекарственных препаратов распространится на все лекарства и всех участников оборота.
Оборот немаркированных лекарств с 1 июля 2020 года будет запрещён, за исключением:
- препаратов, произведённых до 1 июля 2020 года;
- препаратов, произведённых до 31 декабря 2019 года и предназначенных для обеспечения больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, а также для обеспечения лиц после трансплантации органов и (или) тканей.
Указанные выше лекарства можно реализовывать, хранить и применять до истечения срока годности.
Для каждого участника в системе МДЛП создаётся свой личный кабинет и предусмотрен свой набор действий по регистрации, направлению сведений в систему и информационному взаимодействию.
Общая схема работы в системе МДЛП:
- Зарегистрированные в системе производители наносят на каждую упаковку лекарственного препарата уникальный идентификационный код — DataMatrix. Код запрашивается у оператора системы через регистратор эмиссии и выдаётся системой. Он наносится на потребительскую (вторичную) упаковку, а если её нет — на первичную упаковку. Сведения о маркировке производители направляют в систему МДЛП.
- Дистрибьюторы, логистические компании и аптеки считывают код с каждого товара и передают в систему сведения о полученных и реализованных лекарственных препаратах.
- Аптеки, осуществляющие бесплатную выдачу лекарств по рецептам, и медицинские организации передают через регистратор выбытия в систему сведения о расходе лекарственных препаратов.
Маркировка лекарственных средств — нормативная база
На данный момент правила маркировки лекарственных средств регламентируются двумя основными документами:
- Федеральный закон от 12.04.2010 «Об обращении лекарственных средств» (далее Федеральный закон № 61-ФЗ).
- Российской Федерации XIII издания (далее ГФ ХIII).
В Федеральном законе № 61-ФЗ не предусмотрены детальные требования. Такая информация прописана в Руководстве по экспертизе лекарственных средств ФГБУ «НЦЭСМП» за 2013 год в руководстве под названием «Оформление макетов упаковок и раздела “Маркировка” нормативной документации на лекарственные средства, поступающие на российский рынок». Именно там содержатся все необходимые сведения по поводу документации, которая должна сопровождать лекарственные средства. Там же находится инструкция об оформлении обеих упаковок — первичной и вторичной, непосредственно потребительской.
Согласно требованиям Федерального закона № 61-ФЗ, все без исключения фармацевтические субстанции должны иметь на первичной упаковке:
- название (оно может быть международным непатентованным или группировочным, химическим или торговым);
- номер серии изготовления, дату;
- указание на производителя (полное название);
- количество и его единицы измерения;
- условия хранения (температура, влажность и т. д.);
Есть и другие данные, которые наносят на упаковку в случае необходимости. К примеру, если для обращения с лекарственным средством необходимы особые условия или повышенная осторожность, это должно быть написано.
Важно: все надписи делаются на русском языке, хорошо читаемым шрифтом.
Обе упаковки (и первичная, и потребительская) в случае, когда внутри находится радиофармацевтическое лекарственное средство, должны иметь специальный знак радиационной опасности (пиктограмму).
— сервис для работы с товарами там, где вам удобно — на компьютере или планшете. Формируйте товарную базу, импортируйте поступившие товары в несколько кликов, печатайте ценники и передавайте данные в 1С.
Кто участвует в системе маркировки
В обороте маркированных фармацевтических товаров участвуют:
- производители;
- оптовые компании;
- розничные точки — аптеки;
- медицинские организации.
Каждая категория имеет свои особенности учёта.
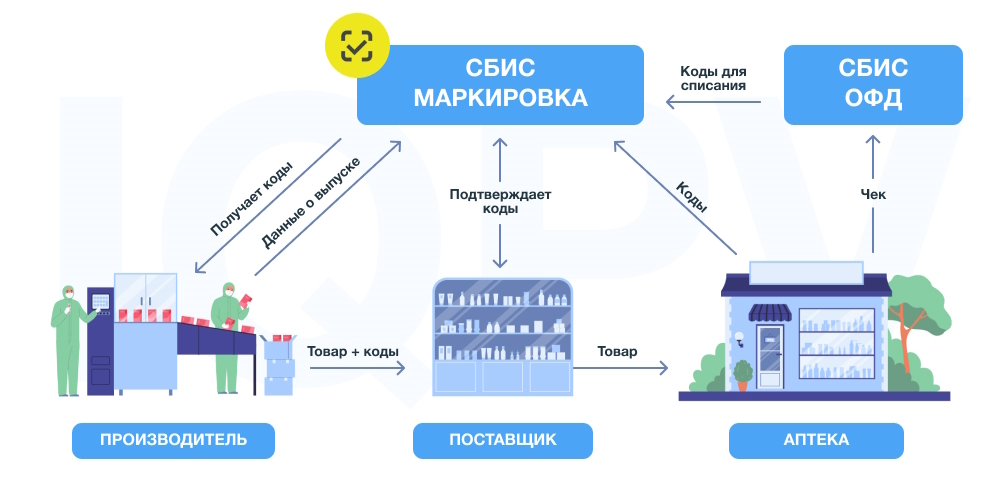
Подробнее о правилах упаковки и маркировки лекарственных средств
В каждом из пунктов, прописанных на упаковке, есть свои особенности.
- Торговое название лекарственного средства должно быть указано в именительном падеже.
- Есть возможность не дублировать общепринятое название, если оно пишется и читается в точности так, как торговое.
- Особые требования к лекарственным средствам на основе сыворотки: на упаковке в обязательном порядке должно присутствовать указание, кровь, плазма, органы или ткани какого из животных стали основой для них – это указано в п. 3 ст. 46 Федерального закона № 61-ФЗ.
- Что касается рекомендаций, которые прописаны в Руководстве по экспертизе ЛС, то для препаратов биологического происхождения есть правило: если нет группировочного или общепринятого названия, должны быть указано, что за источник лежит в основе средства.
- Показатели дозировки (концентрации или активности) должны полностью соответствовать нормативной документации, а также инструкции по применению.
- Способ применения также должен быть указан в точности так, как это прописано в инструкции. Не дублируется путь введения только тогда, когда непосредственное указание на него есть в самом наименовании.
Различия между маркировкой дозированных и недозированных лекарственных средств.
- На упаковке дозированных указывают название вещества и его количество в одной дозе (если нет других указаний).
- Для недозированных этот показатель должен составлять название действующего вещества и его количество на определённую массу или объём.
Парентеральные, глазные, а также лекарственные формы для наружного (местного) применения или ингаляций на упаковке должны содержать не только весь перечень действующих веществ, но также и их количественный состав. Вдобавок должны быть перечислены все дополнительные действующие вещества. Это же касается контроля маркировки лекарственных средств для инфузий.
от Эвотора решает все вопросы по продаже маркированных товаров. Простая регистрация в «Честном Знаке», подключение к ЭДО и оформление ЭЦП — всё внутри приложения.
Как работать с маркировкой
Все участники рынка лекарств регистрируются в системе мониторинга — это первый шаг, и он одинаковый. А вот дальнейшие шаги отличаются.
Дистрибьюторы и логистические компании передают сведения о полученных от производителя и проданных лекарствах в систему мониторинга. Для этого понадобится:
- интегрировать складское программное обеспечение с системой мониторинга лекарств;
- отправлять сведения о покупке или продаже лекарств в систему.
Аптеки передают сведения о полученных от поставщиков лекарствах в систему мониторинга и о проданных упаковках через кассы. Им нужно:
- обновить прошивку онлайн-кассы;
- подключить к кассе 2D-сканер штрих-кодов, если раньше его не использовали;
- обновить кассовую программу;
- получить регистратор выбытия, если аптека выдает лекарства бесплатно, например по льготным рецептам. Такие лекарства проводят через регистратор выбытия, а не кассу. Устройство получают бесплатно в личном кабинете системы «Честный знак»;
- отправлять сведения о получении, продаже или выдачи лекарств в систему через кассу, регистратор выбытия или вручную.
Какой чек пробивать и когда пользоваться регистратором выбытия, зависит от ситуации.
Ситуация
Аптека продает лекарства обычному покупателю
Выбить чек через кассу, в одном чеке может быть всё, что купили: лекарства, салфетки, жвачка и клизма
Аптека продает лекарство со скидкой по льготному рецепту
Выбить чек через кассу, на лекарство со скидкой один чек, на все остальные покупки — другой
Аптека выдает лекарство бесплатно по льготному рецепту
Провести лекарство через регистратор выбытия
Аптека находится в удаленной местности, где касса работает в автономном режиме и ничего не передает оператору фискальных данных
Списать лекарство вручную в системе мониторинга
Аптека работает при фельдшерско-акушерском пункте без кассы
Государственные больницы передают сведения о полученных от поставщиков лекарствах в систему мониторинга, а потом — информацию об использованных лекарствах через регистратор выбытия. Им понадобится:
- интегрировать больничное ПО с системой мониторинга лекарств;
- получить бесплатный регистратор выбытия. Для этого нужно заполнить заявку в личном кабинете системы «Честный знак»;
- отправлять сведения о выдаче или использовании лекарств в систему.
Если в больнице несколько корпусов и складов, на которых работают разные сотрудники, нужно получить регистраторы выбытия и оформить усиленные электронные подписи на каждого, кто будет работать с системой мониторинга. Потому что с одной подписью в один момент может работать только один сотрудник.
Частные клиники, которые используют в работе лекарства. Это клиники общего профиля, стоматологии, косметологические кабинеты, реабилитационные центры и все остальные. Они передают в систему мониторинга сведения об использовании или продаже лекарств.
У частных клиник есть два сценария: пробивать лекарства через кассу или списывать через систему. Какой использовать, зависит от наличия лицензии на фармацевтическую деятельность, она же продажа лекарств:
- есть лицензия на продажу лекарств. Клиника может использовать оба сценария: пробивать лекарства через кассу или списывать в системе мониторинга — на выбор;
- нет лицензии. Клиника пробивает через кассу только услуги, а лекарства списывает в системе мониторинга.
К примеру, косметологическая клиника делает уколы ботокса, но у нее нет лицензии на продажу самого ботокса, только на оказание услуг. Клиника пробивает клиенту чек на услугу «Уколы ботокса», а ампулу с ботоксом списывает в системе мониторинга.
Еще аптеки, частные клиники и больницы взаимодействуют с производителями и поставщиками — обе стороны подтверждают отправку и получение лекарств. Есть два варианта подтверждения:
- прямой. Поставщик первым отправляет в систему данные о том, что он поставил в аптеку столько-то упаковок таких-то лекарств, а аптека у себя в системе подтверждает, что получила именно эти лекарства;
- обратный. Аптека или клиника отправляет в систему данные о том, что получила столько-то упаковок таких-то лекарств, а поставщик у себя в системе подтверждает, что именно эти лекарства отправил.
Поставщик и получатель должны договориться, кто первым отправляет подтверждение о передаче лекарств, но при любом варианте сделать это должны оба. Только после двойного подтверждения лекарства можно продавать или выдавать бесплатно.
Транспортная тара и требования к её маркировке
Требования к маркировке лекарственных средств подразумевают и тару. Транспортная тара используется только для перевозки, она не предназначена для потребителей. Однако при этом существует целый ряд обязательных сведений, которые она должна содержать:
- наименование средства и производителя (также указывается и его адрес);
- серия и дата выпуска;
- количество в каждой таре вторичных упаковок;
- условия перевозки и хранения;
- другие сведения, которые относятся к предупредительным или манипуляторным знакам.
Как работает система маркировки
Идентификатор к товару привязывают производители или импортеры, после чего он поступает к оптовикам и в розничные точки. Каждый участников оборота должен зафиксировать операции, которые совершаются над маркированным товаром.
Как правило, фиксируется две основные операции: приёмка и отпуск потребителю. В случае аптеки к таким операциям относятся приёмка товара от оптового поставщика и отпуск физическому лицу. Каждый участник оборота для регистрации операций использует специальные квалифицированные электронные подписи (КЭП).
Таким образом формируется логистическая цепочка, которая позволяет проследить путь промаркированного товара от производителя к конечному потребителю. Несанкционированному участнику, например изготовителю фальсифицированных лекарственных средств, очень сложно «вклиниться» в эту цепочку, так как незаметно получить и использовать КЭП законного участника оборота практически невозможно.
Прочитать QR-код на упаковке и отследить логистическую цепочку может каждый участник, включая конечного покупателя.
Глава Росздравнадзора в июне 2022 года отмечала, что за последние пять лет общее количество забракованных серий лекарств (фальсифицированных, контрафактных и недоброкачественных) уменьшилось в четыре раза. В том числе благодаря введению системы маркировки.

Каким требованиям должны отвечать участники оборота лекарственных препаратов
Маркировка не отменяет обязанностей участников оборота, связанных с экспертизой и государственной регистрацией лекарственных препаратов, как и в целом требований, предъявляемых к участникам рынка в соответствии с №61-ФЗ «Об обращении лекарственных средств». Однако в связи с внедрением обязательной маркировки появился ряд новых требований — они обеспечивают возможность работы в системе МДЛП и предусматривают:
- Наличие специального оборудования и программного обеспечения.
- Регистрацию в системе, для чего нужна квалифицированная электронная подпись.
- Соблюдение установленного порядка передачи сведений в систему для регистрации, маркировки и учёта движения лекарственных препаратов.
Производители (фармацевтические компании) должны быть оснащены регистратором эмиссии — промышленным программно-аппаратным комплексом для генерации ключа и проверочного кода, а также хранения кодов маркировки. Для его получения нужно подать заявку Оператору-ЦРПТ. С производителем заключаются договоры по предоставлению регистратора эмиссии и оказанию услуг по предоставлению кодов маркировки.
Медицинские организации и аптеки, осуществляющие бесплатную реализацию маркированных лекарственных препаратов, должны быть оснащены регистраторами выбытия по количеству мест ведения деятельности. Регистратор — это аналог онлайн-кассы, только для фиксации бесплатного отпуска лекарств. Устройства поставляются Оператором-ЦРПТ, который также обеспечивает их обслуживание.
Не требуется оснащать регистратором выбытия:
- медучреждения Минобороны;
- медицинские (врачебные) кабинеты, действующие в школах, детсадах или в других организациях, при условии, что такие кабинеты входят в структуру медицинской организации;
- структурные подразделения, которые получают препараты из своей головной медицинской организации;
- аптеки (пункты, киоски), которые не реализуют препараты на бесплатной основе по рецепту.
Аптеки, которые занимаются розничной продажей лекарственных препаратов, могут ограничиться имеющимся оборудованием — онлайн-кассой и присоединённым сканером для считывания кода (2D сканер штрихкода). Если розничной продаже сопутствует выдача лекарств по льготным рецептам, нужно дополнительно оснастить аптеку регистратором выбытия.
Зарегистрированные дистрибьюторы используют имеющиеся программно-технические средства, но их обязательно необходимо интегрировать с системой МДЛП (в составе системы Честный ЗНАК).
Вопросы и ответы
В момент отпуска только части упаковки, происходит «частичное» выбытие вторичной упаковки. Она должна сохраняться до момента отпуска последней доли упаковки. Для этого необходимо ввести «долю» упаковки на кассовом ПО.
В случае обнаружения попытки осуществить вывод «излишка» система мониторинга зафиксирует нарушение!
Что делать, если покупатель отказался от покупки?
Бывает, так что покупка не состоялась (отказ по инициативе покупателя, отсутствие необходимой суммы денежных средств), а маркированный лекарственный препарат «пробит» на кассе в аптеке.
В этом случае чек не закрывается и должен быть аннулирован посредством программного обеспечения.
Операция пробития чека не состоялась — информация не передалась ОФД, поэтому сведения о выбытии товара в системе мониторинга не зафиксировались.

Первичная и вторичная упаковки и их маркировка
Первичная упаковка — основная. К ней предъявляются жёсткие требования:
- название лекарственного средства;
- серия и её номер;
- дата выпуска (обязательна для иммунобиологических препаратов);
- дозировка (может быть заменена на концентрацию);
- активность в единицах действия (может быть количество доз);
Требование к шрифту одно: он должен быть понятным, при этом язык написания — только русский.
Лекарственные средства на основе растительного сырья должны быть промаркированы надписью «Продукция прошла радиационный контроль».
Вторичная упаковка лекарственного ещё называется потребительской. К ней, помимо указанных выше, предъявляют такие требования:
- условия отпуска лекарственного средства;
- различные надписи предупредительного характера.
Также на вторичной упаковке должен быть код маркировки DataMatrix. Если вторичная упаковка не предусмотрена, то код наносится на первичную.
Если лекарственное средство произведено из плазмы или крови, тканей или органов человека, то на вторичной упаковке обязательно должно быть : «Антитела к ВИЧ-1, ВИЧ-2, к вирусу гепатита C и поверхностный антиген вируса гепатита B отсутствуют».
Подытожим
Все лекарственные препараты и средства в РФ в обязательном порядке должны быть маркированными. легальность того или иного лекарства очень просто – нужно всего лишь считать код. маркировки подразумевает, что в него «зашита» вся необходимая информация.
Получайте раз в неделю подборку лучших статей Жизы
Рассказываем истории из жизни бизнесменов, следим за льготами для бизнеса и
даём знать, если что-то срочно пора сделать.
Какие лекарства нужно маркировать
С 1 июля 2020 года производители обязаны маркировать все лекарства, кроме бадов. По закону лекарствами считаются:
«вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, прерывания или сохранения беременности».
Получается, ветеринарные лекарства тоже нужно маркировать.
Функции маркировки на фармацевтическом рынке
Основные функции маркировки заключаются в защите рынка от попадания некачественных лекарственных препаратов или товаров аптечного ассортимента и в предоставлении возможности каждому участнику оборота проверить подлинность товара, его производителя и срок изготовления.
В ст. 4 Федерального закона от 12.04.2010 № 61 «Об обращении лекарственных средств» определено три группы некачественных лекарственных препаратов:
- недоброкачественные — лекарство, которое не соответствует требованиям фармакопейной статьи, нормативной документации или нормативного документа;
- контрафактные — лекарство, которое находится в обороте с нарушением гражданского законодательства;
- фальсифицированные — лекарство, которое сопровождается ложной информацией о производителе или составе.
Последние две группы препаратов редко проходят надлежащий контроль в ходе их производства и изготовления, из-за чего могут быть опасными для людей. Для защиты препаратов от подделок производители используют различные предупредительные меры: изменение упаковки, защитные голограммы, специальные идентификационные знаки или специфические шрифты и так далее. Однако даже они не гарантируют полной защиты.
Статья 46. Маркировка лекарственных средств
12. На вторичную (потребительскую) упаковку лекарственного препарата наносится штриховой код.
Федеральный закон N 61-ФЗ «Об обращении лекарственных средств»
Именно с целью повышения безопасности лекарственных препаратов, на фармацевтическом рынке России была внедрена система маркировки при помощи специальных кодов.
Штрих-код — это графическая информация (последовательность полос или других геометрических фигур), которая наносится на упаковку товаров для считывания ее техническими средствами. Чаще всего используется EAN-код — линейный. Он может кодировать небольшой объем информации.
Если в самом начале она действовала в отношении лекарственных препаратов, то постепенно вводится повсеместная маркировка в отношении продуктов детского питания, БАДов, антисептиков, воды и других товаров, которые реализуют аптеки.
Например Постановление Правительства РФ N 673 «О проведении на территории Российской Федерации эксперимента по маркировке средствами идентификации биологически активных добавок к пище» регламентирует эксперимент по маркировке средствами идентификации БАД, проводимый с 1 мая 2021 года по 28 февраля 2023 года.
Аналогичные задачи в отношении кожных антисептиков поставлены в Постановлении Правительства РФ N 1240 «О проведении на территории Российской Федерации эксперимента по маркировке средствами идентификации парфюмерно-косметической продукции, предназначенной для гигиены рук, с заявленным в маркировке потребительской тары антимикробным действием, а также кожных антисептиков — дезинфицирующих средств».

В планах Минпромторга стоит запуск обязательной маркировки БАД и антисептиков сразу после завершения эксперимента. Предусмотрен переходный период для производителей и импортеров, который будет длиться до 1 апреля 2023 года. Розничные поставщики должны будут настроить системы передачи информации о кодах проданных БАД и дезсредств до 1 сентября 2023 года.
Особенности работы с системой маркировки
Можно выделить общую схему взаимодействия между участниками оборота:
- Производитель получает коды в системе маркировки и размещает их на упаковках лекарственных препаратов.
- Во время отгрузки вместе с товаром производитель передаёт дистрибьютору список кодов.
- Дистрибьютор проводит приёмку товара и подтверждает получение кодов.
- Дистрибьютор выполняет расфасовку товара и направляет его в аптеку.
- Аптека проводит приёмку, во время которой происходит сканирование кодов с упаковок лекарств.
- Отсканированные коды направляются поставщику в систему МДЛП (Мониторинг Движения Лекарственных Препаратов).
- При отпуске и продаже фармацевт или провизор сканирует код маркировки на упаковке, после чего оператор фискальных данных отправляет его в систему маркировки.
- Код выбывает из оборота.
Таким образом отслеживается весь путь перемещения лекарственных препаратов, начиная с момента производства и до их получения покупателями. Контролирующие органы в любой момент времени смогут узнать, где находится фармацевтический товар и сколько времени осталось до окончания срока его годности.
Отгрузка лекарственных средств может проходить по прямому или обратному акцепту:
- прямой порядок акцептования («прямой акцепт»). Сведения об отгрузке товара регистрируются отправителем. Получатель подтверждает зарегистрированные в системе сведения;
- обратный порядок акцептования («обратный акцепт»). Сведения об отгрузке товара регистрируются получателем. Отправитель подтверждает зарегистрированные в системе сведения.
«Прямой акцепт» более точен, так как проверка штрих-кодов производится как со стороны получателя, так и со стороны отправителя. Это уменьшает вероятность возникновения пересортицы. Но не все дистрибьюторы готовы к такой форме работы — для этого требуется дополнительные оборудование и персонал.
Поэтому «Обратный акцепт» остается самым распространенным способом взаимодействия дистрибьютора с аптечными сетями. Аптека, получив поставку, должна просканировать все упаковки товара в рамках одной накладной, сформировать документ установленного вида и отправить его в систему мониторинга движения лекарственных средств. Эта информация сверяется с данными, которые вносит дистрибьютор. Если данные совпадают — считается, что поставка состоялась. Аптека получает сообщение, что поставка принята.

Программа маркировки лекарственных препаратов даёт возможность быстро принять партию лекарственных средств и других товаров аптечного ассортимента любого объема. Специализированное программное обеспечение позволяет провести приём и отказ от приема, возврат и выбытие товаров, а также узнать статус маркировочного кода препарата.
Розничная продажа лекарств в аптеках
Система мониторинга маркированных товаров имеет несколько видов вывода лекарственных препаратов из оборота:
- розничная продажа — аптека отпустила товар покупателю за полную стоимость;
- льготный отпуск — аптека отпустила товар покупателю за частичную стоимость;
- вывод из оборота для оказания медицинской помощи — вывод лекарства из-за использования медицинской организацией для предоставления медицинской помощи;
- вывод из оборота по иным причинам.
К иным причинам относится уничтожение препарата и списание без передачи на уничтожение, недостача, производственный брак, частичное списание и так далее.
Для «вывода» лекарства из оборота аптеке требуется контрольно-кассовая техника, актуальное кассовое программное обеспечение и сканер для считывания 2D-кодов.
Особых различий в реализации аптекой лекарственных препаратов и других товаров нет. Фармацевт или провизор при отпуске товара сканирует код маркировки, который вместе с другой информацией автоматически поступает в систему мониторинга. Передача сведений происходит в несколько этапов:
- при расчёте с покупателем формируются фискальный документ и кассовый чек;
- фискальный документ шифруется и передается ОФД (Оператору фискальных данных), а затем поступает в ФНС (Федеральную налоговую службу);
- ФНС подтверждает операцию и передаёт сведения в систему мониторинга.

Чтобы избежать ошибок при реализации товара, рекомендуется придерживаться следующего алгоритма действий при отпуске маркированных товаров:
- Получение запроса от покупателя и предоставление фармацевтической консультации.
- Подобрать подходящие покупателю лекарственные препараты и получить его согласие на их покупку.
- Последовательно считать при помощи сканера коды маркировки DataMatrix с каждой упаковки лекарственных препаратов. При повторном сканировании одной и той же упаковки регистратор выбытия не добавит ее в список для вывода из оборота, а сообщит об ошибочном сканировании.
- Проверить корректность считывания кодов маркировки.
- Получить оплату за товары аптечного ассортимента и пробить кассовый чек.
- Передать покупателю товар, сдачу и кассовый чек.
Похожим образом построена пошаговая инструкция отпуска лекарственных препаратов по льготным рецептам:
- Получить от покупателя льготный рецепт.
- Подобрать подходящие препараты для отпуска и получить согласие покупателя на их отпуск.
- Последовательно считать при помощи сканера коды маркировки DataMatrix с каждой упаковки лекарственных препаратов.
- Ввести дату, серию и номер рецепта на регистраторе выбытия или в товарно-учетной системе, после чего выбрать действие «Зарегистрировать выбытие».
- Выдать товар покупателю после появления на дисплее регистратора сообщения об отправке запроса.
Задачи системы мониторинга перемещения лекарственных препаратов
Данная система является центральным элементом процесса, раскрывает суть маркировки лекарственных средств. База содержит информацию про производителей, импортеров, изготовителей. Дистрибьютеров, продавцов медикаментов и такие действия с фармацевтической продукцией:
- ввод лекарств в обращение;
- операции по перемаркировке и переупаковке;
- формирование новой комплектации медикаментов;
- вывод препаратов из обращения и др.
Информационная система мониторинга движения лекарств – это элемент Национальной системы «Честный знак», основная задача которой заключается в том, чтобы защитить потребителей от низкокачественной продукции. При отсутствии специального кода на лекарстве или нарушении норм при его нанесении, товар не может добавляться в систему.
Лекарства маркируют производители и импортеры
Лекарства маркируют производители и импортеры: наносят код на каждую упаковку, а затем передают сведения об операциях с лекарствами в систему мониторинга. Операциями считаются передача логистической компании, оптовая или розничная продажа, уничтожение.
Чтобы маркировать лекарства, нужно:
Заявка на регистратор эмиссии заполняется в личном кабинете системы «Честный знак» в разделе Профиль — Анкеты и договоры
Остальные участники рынка не наносят маркировку, а только передают сведения об операциях с лекарствами — продаже, выдаче или использовании.
Сейчас аптеки продают некоторые лекарства поштучно, например пакетик Смекты или пять ампул антибиотика из коробки с десятью ампулами. Это помогает покупателям экономить: упаковка с десятью ампулами может стоит 8000 рублей, и, если врач прописал пять уколов, выгоднее купить половинку.
Но из-за того, что код маркировки лекарств должен наноситься на вторичную упаковку — коробку, а на ампулах, пакетиках со смесями и блистерах маркировки нет, скорее всего, поштучная продажа будет запрещена.
Маркировка лекарственных средств и сроки ее проведения
Внедрение маркировки медикаментов проходило поэтапно:
- (с 01.07.2019 г.) Регистрация всех участников оборота лекарств, которые используются в лечении состояний, о которых говорилось выше, в системе «Честный знак».
- (с 01.10.2019 г.) Обязательная маркировка препаратов для лечения данных состояний. При этом, если дата выпуска лекарства до 31.12.2019 г., его хранение, перевозка, отпуск, продажа допускаются без знаков идентификации до того момента, пока не закончится срок их годности, согласно части 7.1 ст. 67 № 61-ФЗ.
- (01.01.2020-29.02.2020 гг.) Все организации, которые задействованы в обороте лекарств, а не только те, которые работают с препаратами для лечения вышеупомянутых состояний, должны пройти процедуру регистрации в государственной системе мониторинга «Честный знак». Если оборот лекарственных средств начался после 29.02.2020 года, регистрация должна пройтись за 7 календарных дней с того момента, когда была начата соответствующая деятельность.
- (с 01.07.2020 г.) Обязательная маркировка лекарственных препаратов всех видов. Фармацевтические производители и компании, занимающиеся импортом медикаментов, должны обеспечивать проставление кода Data Matrix на упаковке, а также передавать данные про операции с медикаментами в систему мониторинга.
«Честный знак» — маркировка лекарств
«Честный знак» — маркировка лекарственных средств и препаратов, работающая по всей территории Российской Федерации. Она обязательна, присоединиться к системе легко — нужно пройти регистрацию и создать личный кабинет.
Суть маркировки — в нанесении уникального кода DM (DataMatrix) поверх каждой упаковки с лекарствами. За счёт кода можно не только идентифицировать препарат, но и проследить его путь от производителя либо таможенного склада до полки аптеки (офлайн или онлайн).
На начало 2022 года реализация лекарственных препаратов, которые не внесены в систему и не маркированы специальным кодом, невозможна.
Маркировка лекарственных препаратов «Честный знак» стартовала 1 июля 2019 года и проходила поэтапно. лекарственных препаратов и средств в системе происходит от выпуска и до реализации — в этот момент товар выбывает из системы.
Особенности регистрации
Чтобы пройти процедуру регистрации в системе маркировки лекарственных препаратов, нужно сначала проверить наличие требуемой версии операционной системы: Windows (7 и выше) и Mac OS (10.8 и выше). Можно использовать такие виды браузеров: Mozilla Firefox, Opera, Internet Explorer 11, Safari Google Chrome.
Требуется загрузка криптографического плагина и драйверов для электронно-цифровой подписи. Инструкция доступна на официальных порталах производителей или в центр, где проводилось оформление цифровой подписи.
Последовательность действий при регистрации:
- Проверяется, есть ли на компьютере все необходимые программы. Если все нормально, осуществляется переход к следующему этапу. В противном случае нужно проверить наличие требуемых программ.
- В открывшейся форме вводятся данные про сертификат электронно-цифровой подписи и контактная информация.
- Оператор рассматривает заявку. Ответ будут направлен на указанный адрес электронной почты. При положительном ответе письмо также будет содержать ссылку, при нажатии на которую произойдет вход в Личный кабинет.
- Далее нужно заполнить все пункты в профиле.
- После указания всех данных начнется их обработка. Произойдет автоматическое закрытие Личного кабинета.
Нужно авторизоваться повторно и можно приступать к работе. На этом процесс регистрации заканчивается.
Какие нормативно-правовые акты регулируют маркировку лекарств
Поскольку проект по маркировке лекарственных препаратов реализуется на протяжении уже нескольких лет, нормативная база создавалась постепенно. На сегодняшний день она представлена:
- Федеральным законом «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ в последней редакции.
- Постановлением Правительства РФ от 24 января 2017 г. № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» с изменениями и дополнениями от 30.12.2017, 28.08.2018 и 07.08.2019.
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» с изменениями и дополнениями от 30.08.2019.
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1557 «Об особенностях внедрения системы мониторинга движения лекарственных препаратов для медицинского применения».
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1558 «Об утверждении Правил размещения общедоступной информации, содержащейся в системе мониторинга движения лекарственных препаратов для медицинского применения, в информационно-телекоммуникационной сети „Интернет“ (в том числе в форме открытых данных)».
- Постановлением Правительства РФ от 8 мая 2019 г. № 577 «Об утверждении размера платы за оказание услуг по предоставлению кодов маркировки, необходимых для формирования средств идентификации и обеспечения мониторинга движения товаров, подлежащих обязательной маркировке средствами идентификации, а также о порядке её взимания».
В чём плюсы маркировки лекарств
У маркировки лекарств есть плюсы для потребителей и продавцов: подлинность лекарств, контроль сроков годности и упрощенный учет партий.
Подлинность. После введения обязательной маркировки потребители смогут проверять подлинность лекарств в приложении «Честный знак» и сообщать о нарушениях. Это поможет честным продавцам бороться с подделками, а потребителям — получать качественные лекарства.
Контроль сроков годности. В код маркировки зашивается срок годности, и, если у лекарства он истек, система мониторинга автоматически его спишет, а касса не даст провести. Это значит, что аптеки не смогут продавать просроченные лекарства, а система мониторинга поможет следить за тем, у каких лекарств на складе скоро истечет срок годности.
Упрощенный учет. Есть лекарства, цена которых зависит от партии поставки. Например, к ним относятся все жизненно необходимые лекарства: наценку на них регулирует государство, она может меняться. Поэтому лекарства из одной партии стоят 100 рублей, а из следующей — 105 рублей, и аптека не вправе продавать упаковки из разных партий по одной цене.
Чтобы контролировать цены лекарств из разных партий, аптеки ведут серийный учет, например клеят вручную внутренние штрихкоды с серийными номерами на каждую упаковку. После введения маркировки станет возможным появление системы, которая будет автоматически учитывать партию поставки. Это значит, что учет лекарств станет проще.
Заключение
Введение обязательной маркировки лекарственных средств было необходимым решением для снижения доли контрафактных и поддельных лекарственных средств в обороте. Перед проектом «Маркировка» стоят масштабные цели, но их достижение обеспечит результаты, в которых заинтересованы все участники жизненного цикла препарата.
Внедрение системы мониторинга и перестройка рабочего процесса изначально могут показаться сложными и пугающими. Но стоит запастись терпением, выполнять необходимые рекомендации, и в скором времени каждый сотрудник фармацевтической отрасли сможет оценить важность этого проекта.
